domingo, 14 de octubre de 2012
SOLUCIONES QUÍMICAS PARA 6º AÑO IPEA 214
Soluciones (o disoluciones) químicas |
Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.(Ver: El agua como solvente).
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Mayor o menor concentración
Ya dijimos que las disoluciones son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración.
Dependiendo de su concentración, las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y enunidades químicas.
Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.

b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Ejercicio:
Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o concentraciones
V1 • C1 = V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se obtiene:
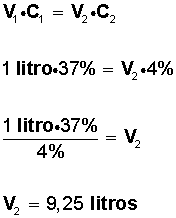
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de agua agregado
9,25 – 1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
Unidades químicas de concentración
Para expresar la concentración de las soluciones se usan también sistemas con unidades químicas, como son:
a) Fracción molar
b) Molaridad M = (número de moles de soluto) / (1 litro de solución)
c) Molalidad m = (número de moles de soluto) / (1 kilo de solvente)
a) Fracción molar (Xi): se define como la relación entre los moles de un componente (ya sea solvente o soluto) de la solución y los moles totales presentes en la solución.
Ejercicio:
Se agregan 3 gramos de sal en una cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que la fracción molar expresa la concentración de una solución en Moles de Soluto o de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores significativos: moles de solvente, moles de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de solvente H2O) tenemos:
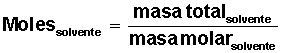
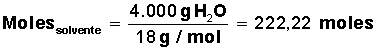
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
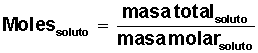
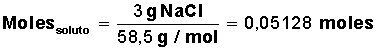
Ahora que conocemos la cantidad de moles de solvente y la cantidad de moles de soluto, podemos calcular las fracciones molares de solvente y de soluto:
Fracción molar del solvente = Xsolvente
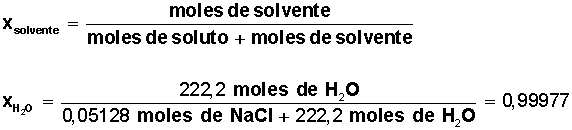
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto

Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
b) Molaridad (M): Es el número de moles de soluto contenido en un litro de solución. Una solución 4 molar (4 M) es aquella que contiene cuatro moles de soluto por litro de solución.
Ejercicio:
¿Cuál será la molaridad de una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
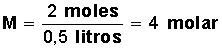
Respuesta: 4 molar
(Ver: PSU: Química; Pregunta 12_2006)
c) Molalidad
En primer lugar debemos advertir que molalidad no es lo mismo que molaridad por lo cual debemos evitar confundirlas puesto que el nombre es muy parecido pero en realidad cambian mucho los cálculos, y es un grave error pero muy frecuente.
En la molalidad relacionamos la molaridad del soluto con el que estamos trabajando con la masa del disolvente (en kg) que utilizamos.
La definición de molalidad es la siguiente:
Relación entre el número de moles de soluto por kilogramos de disolvente (m)

Solubilidad
En química, la solubilidad mide la capacidad de una determinada sustancia para disolverse en un líquido.
Algunos líquidos, tales como agua y alcohol, pueden ser disueltos en cualquier proporción en otro solvente. Sin embargo, el azúcar tiene un límite de solubilidad ya que al agregar cierta cantidad adicional en una solución está dejará de solubilizarse, llamándose a esta solución saturada.
Es la proporción en que una cantidad determinada de una sustancia se disolverá en una cantidad determinada de un líquido, a una temperatura dada.
En términos generales, es la facilidad con que un sólido puede mezclarse homogéneamente con el agua para proporcionar una solución química.
Concepto
La solubilidad es la mayor cantidad de soluto (gramos de sustancia) que se puede disolver en 100 gramos (g). de disolvente a una temperatura fija, para formar una disolución saturada en cierta cantidad de disolvente.
Las sustancias no se disuelven en igual medida en un mismo disolvente. Con el fin de poder comparar la capacidad que tiene un disolvente para disolver un producto dado, se utiliza una magnitud que recibe el nombre de solubilidad.
La capacidad de una determinada cantidad de líquido para disolver una sustancia sólida no es ilimitada. Añadiendo soluto a un volumen dado de disolvente se llega a un punto a partir del cual la disolución no admite más soluto (un exceso de soluto se depositaría en el fondo del recipiente). Se dice entonces que está saturada.
Pues bien, la solubilidad de una sustancia respecto de un disolvente determinado es la concentración que corresponde al estado de saturación a una temperatura dada.
Las solubilidades de sólidos en líquidos varían mucho de unos sistemas a otros. Así a 20º C la solubilidad del cloruro de sodio (NaCl) en agua es 6 M (molar) y en alcohol etílico (C2H6O), a esa misma temperatura, es 0,009 M (molar). Cuando la solubilidad es superior a 0,1 M (molar) se suele considerar la sustancia como soluble en el disolvente considerado; por debajo de 0,1 M (molar) se considera como poco soluble o incluso como insoluble si se aleja bastante de este valor de referencia.
La solubilidad depende de la temperatura; de ahí que su valor vaya siempre acompañado del de la temperatura de trabajo. En la mayor parte de los casos, la solubilidad aumenta al aumentar la temperatura.
Factores que determinan la solubilidad
Solubilidad en líquidos: al elevar la temperatura aumenta la solubilidad del soluto gas en el líquido debido al aumento de choques entre moléculas contra la superficie del líquido. También ocurre lo mismo con la presión.
Solubilidad de líquidos en líquidos: Al aumentar la temperatura aumenta la solubilidad de líquidos en líquidos. En este caso la solubilidad no se ve afectada por la presión.
Solubilidad de sólidos en líquidos: la variación de solubilidad está relacionada con el calor absorbido o desprendido durante el proceso de disolución. Si durante el proceso de disolución se absorbe calor la solubilidad crece con el aumento de la temperatura, y por el contrario, si se desprende calor durante el proceso de disolución, la solubilidad disminuye con la elevación de temperatura. La presión no afecta a la solubilidad en este caso.
Unidades de medida
Puesto que la solubilidad es la máxima concentración que puede alcanzar un soluto, se medirá en las mismas unidades que la concentración.
Es habitual medirla en gramos de soluto por litro de disolución (g/l) o en gramos de soluto por cada 100 cc de disolución (%).
Aunque la unidad de medida se parezca a la de la densidad, no es una medida de densidad. En la densidad, masa y volumen se refieren al mismo cuerpo. En la solubilidad, la masa es de soluto y el volumen es de la disolución, de la mezcla de soluto y disolvente.
Fuentes Internet:
Más sobre el tema:
Apuntes química general, Dr. Pizarro. PUC.
Es propiedad: www.profesorenlinea.cl. Registro Nº 188.540
lunes, 6 de agosto de 2012
LOS COMPUESTOS DEL CARBONO
En los
comienzos de la química, se pensaba que ciertas sustancias, como por ejemplo,
los azúcares, las grasas o las proteínas no podían fabricarse en el laboratorio,
sino que sólo se podían sintetizar en el organismo, por lo que se las llamó
ORGÁNICAS.
En 1828
el químico FRIEDRICH WÖNLER logró sintetizar el primer compuesto orgánico: la
UREA y probó que era posible fabricar sustancias orgánicas en el laboratorio.
Más tarde, en 1845 el químico alemán ADOLF KOLBE sintetizó ácido acético,
llamado comúnmente VINAGRE.
El avance
de la química orgánica fue vertiginoso tanto que hoy se conocen millones de
compuestos orgánicos, entre ellos, los medicamentos, los plásticos, etc.
CARACTERÍSTICAS DE LAS SUSTANCIAS ORGÁNICAS
Las
sustancias orgánicas, en especial aquellas que sólo contienen carbono e
hidrógeno, presentan las siguientes propiedades:
• No son
buenos conductores del calor y la electricidad.
• No son
solubles en agua, pero sí lo son en solventes orgánicos.
• Tienen
bajos puntos de fusión y ebullición.
EL CARBONO
El
carbono es un elemento estrictamente relacionado con la vida. La mayoría de las
estructuras de los seres vivos están formadas por átomos de carbono. Casi el
18% de la materia viva está formada por carbono. Este porcentaje es muy alto
teniendo en cuenta que el resto es fundamentalmente agua.
La
particularidad del carbono reside en que sus átomos pueden unirse entre sí
mediante enlaces covalentes formando cadenas carbonatadas de un número variable
de átomos que pueden ser abiertas o cerradas, lineales o ramificadas.
De esta
manera puede presentarse en diferentes variedades alotrópicas como el carbono
grafito y el carbono diamante.
Para
formar enlaces, el carbono tiene disponibles cuatro electrones en su último
nivel energético. En realidad, dos de estos electrones están apareados y dos
desapareados, pero, como el átomo de carbono HIBRIDIZA (mezcla sus orbitales)
presenta cuatro electrones desapareados y disponibles para formar enlaces:
Los
nuevos orbitales resultantes de la hibridación se disponen en el espacio orientados
hacia los vértices de un tetraedro regular:
HIDROCARBUROS
Los
hidrocarburos, como su nombre lo indica, están formados sólo por carbono e
hidrógeno. Son los compuestos orgánicos más simples y pueden ser considerados como
las sustancias principales de las que derivan los demás compuestos orgánicos.
“C”
CADA CARBONO SIEMPRE DEBE TENER
COMO MÁXIMO 4 LI GADURAS.
Los
hidrocarburos se clasifican en SATURADOS e INSATURADOS según si poseen simples,
dobles o triples ligaduras:
ALCANOS
Son
hidrocarburos saturados que poseen simple ligadura entre sus átomos de carbono.
El término más sencillo de la serie es el METANO.
HIDROCARBUROS SATURADOS: Poseen el número máximo de hidrógenos
posibles.
INSATURADOS: No poseen el número máximo de hidrógenos posibles .
ALCANOS: Poseen simple ligadura entre carbono y carbono.
ALQUENOS: Poseen doble ligadura entre carbono y carbono.
ALQUINOS: Poseen triple ligadura entre carbono y carbono.
ALCANOS
El metano
presenta una estructura tetraédrica en la que el átomo de carbono ocupa la posición central y los
hidrógenos se ubican en los vértices de un
tetraedro regular. Es también llamado “GAS de los pantanos” y se libera de las sustancias
orgánicas cuando éstas se degradan o descomponen por acción de las bacterias.
Los
cuatro primeros términos de la serie de los alcanos son:
En el
siguiente gráfico se presentan las estructuras tridimensionales de las moléculas
de METANO, ETANO, PROPANO Y BUTANO respectivamente:
Si
observamos los cuatro primeros términos de la serie de los alcanos, veremos que
hay una relación entre los átomos de carbono e hidrógeno que se sintetiza en su
FÓRMULA MOLECULAR:
Por
ejemplo si un alcano tiene 8 átomos de carbono para calcular los átomos de
hidrógeno utilizamos la fórmula anterior:
Metano
Etano
Propano
Butano
FORMULA GENERAL DE LOS ALCANOS
CnH2n+2
Esto
quiere decir que por cada átomo de carbono que haya en la molécula de un alcano
debe haber el doble de átomos de hidrógeno más 2.
Calcule
la fórmula molecular para un alcano de 18 átomos de carbono.
¿Cómo se nombran los alcanos de cadena lineal?
1. Los
cuatro primeros términos de la serie tienen nombres particulares:
Metano,
Etano, Propano y Butano.
2. Todos
tienen terminación “ano”
3. A
partir del alcano de 5 átomos de carbono se utilizan distintos
Prefijos
griegos que indican el número de átomos de carbono como indica la siguiente
tabla:
Por
ejemplo:
LOS ALCANOS PUEDEN SER DE CADENA LINEAL, COMO LOS QUE
HEMOS VISTO, O DE CADENA RAMIFICADA.
Los
alcanos de cadena ramificada son compuestos que tienen cadenas cortas
(Sustituyentes)
unidas a la cadena principal (cadena más larga).
¿Cómo se nombran los alcanos de cadena ramificada?
1. Se
busca la cadena carbonatada más larga.
2. Se
identifica la cadena principal y las ramificaciones.
3. Se
enumera la cadena principal de forma tal que él o los Sustituyentes tengan el
menor número.
Debo
numerar la cadena de arriba hacia abajo ya que de esta manera el sustituyente
queda con el menor número.
4.
Finalmente se nombran los sustituyentes y la cadena principal.
2 METIL PENTANO
5. Cuando
un sustituyente se repite en la molécula se utilizan los prefijos
di, tri,
tetra, etc. para indicar la cantidad total de sustituyentes.
Actividad 7
1)
Escriba la fórmula semidesarrollada y molecular de los siguientes
Compuestos:
a) 2
metil propano
b) 2-3
dimetil heptano
c) 2-2
dimetil nonano
d) 2-3-4 trimetil
hexano
martes, 5 de junio de 2012
PARA 4º AÑO IPEA 214
TRABAJO PRACTICO
REPRESENTACIÓN DE ORBITALES
MATERIALES
PROCEDIMIENTO:
1) UNE TRES TROZOS DE ALAMBRE DE MODO QUE REPRESENTEN LOS TRES EJES DEL ESPACIO "X" , "Y" y "Z". PARA QUE MANTENGAN LA ORIENTACIÓN ASIGNADA, ÁTALOS CON EL HILO DE COSER.
2) SOBRE ESTOS TRES EJES, MOLDEA PLASTILINA ROJA DE MODO QUE REPRESENTE UN ORBITAL S CUYO DIÁMETRO TENGA 2 cm.
3) TOMA TRES TROZOS DE ALAMBRES Y UNELOS CON HILO DE COSER , DE MANERA QUE REPRESENTEN LOS TRES EJES DEL ESPACIO COMO EL INCISO 1.
4) CON PLASTILINA VERDE, MOLDEA SOBRE ESTOS TRES EJES LOS ORBITALES P DEL SIGUIENTE MODO: PRIMERO, EL ORBITAL Px; LUEGO, EL Py, Y , POR ULTIMO EL ORBITAL Pz.
5)DIBUJA EL ORBITAL S Y LOS TRES ORBITALES P QUE HAS CONFECCIONADO.
REPRESENTACIÓN DE ORBITALES
MATERIALES
- PLASTILINA ROJA Y VERDE.
- 6 TROZOS RECTOS DE ALAMBRES DE UNOS 15 CM DE LONGITUD.
- 1 TIJERA
- HILO DE COSER
PROCEDIMIENTO:
1) UNE TRES TROZOS DE ALAMBRE DE MODO QUE REPRESENTEN LOS TRES EJES DEL ESPACIO "X" , "Y" y "Z". PARA QUE MANTENGAN LA ORIENTACIÓN ASIGNADA, ÁTALOS CON EL HILO DE COSER.
2) SOBRE ESTOS TRES EJES, MOLDEA PLASTILINA ROJA DE MODO QUE REPRESENTE UN ORBITAL S CUYO DIÁMETRO TENGA 2 cm.
3) TOMA TRES TROZOS DE ALAMBRES Y UNELOS CON HILO DE COSER , DE MANERA QUE REPRESENTEN LOS TRES EJES DEL ESPACIO COMO EL INCISO 1.
4) CON PLASTILINA VERDE, MOLDEA SOBRE ESTOS TRES EJES LOS ORBITALES P DEL SIGUIENTE MODO: PRIMERO, EL ORBITAL Px; LUEGO, EL Py, Y , POR ULTIMO EL ORBITAL Pz.
5)DIBUJA EL ORBITAL S Y LOS TRES ORBITALES P QUE HAS CONFECCIONADO.
lunes, 28 de mayo de 2012
2º AÑO IPEA Nº 214
SISTEMA HETEROGENEO: MÉTODOS SEPARATIVOS
¿CUALES SON LOS MÉTODOS SEPARATIVOS?
MATERIALES:
1 pinza
1 botella limpia e incolora
1 vaso común o de precipitado
1 embudo de unos 10 cm de diámetro
1 varilla de vidrio o de plástico
1 repasador
1 recipiente de boca ancha ( puede ser un frasco de una mayonesa) conteniendo un sistema heterogeneo formado por 100 ml de agua de la canilla mas de tres cucharadas soperas de arena mas de un corcho cortado en trozos gruesos.
1 trozo de algodón común.
procedimiento:
5. CONCLUSIONES:
A. ¿ cuales son los métodos para la separación de las fases de un sistema heterogeneo que has empleado en este trabajo practico?
B. menciona otros métodos separativos que conozcas.
¿CUALES SON LOS MÉTODOS SEPARATIVOS?
MATERIALES:
1 pinza
1 botella limpia e incolora
1 vaso común o de precipitado
1 embudo de unos 10 cm de diámetro
1 varilla de vidrio o de plástico
1 repasador
1 recipiente de boca ancha ( puede ser un frasco de una mayonesa) conteniendo un sistema heterogeneo formado por 100 ml de agua de la canilla mas de tres cucharadas soperas de arena mas de un corcho cortado en trozos gruesos.
1 trozo de algodón común.
procedimiento:
- observa el sistema heterogeneo en estudio e indica: ¿ cuales son las frases que lo forman?
- con la ayuda de la pinza, extrae los trozos de corchos que hay en el sistema. este procedimiento se llama tria.
- deja reposar el sistema hasta que estén bien separadas las fases. vierte con cuidado el agua que sobrenada( flota) a otro recipiente . esta acción se llama decantacion.
- si el agua esta turbia , prepara un filtro colocando algodón en el interior de un embudo, de modo que el algodón quede bien apretado. coloca el embudo sobre la botella en donde recogeras el agua filtrada. vierte lentamente el agua turbia en el embudo y espera a que filtre a través del algodón. en el recipiente puedes observar agua limpida. este procedimiento lleva un cierto tiempo, no trates de agilizarlo moviendo el embudo y /o botella ten paciencia. este procedimiento se denomina FILTRACION.
5. CONCLUSIONES:
A. ¿ cuales son los métodos para la separación de las fases de un sistema heterogeneo que has empleado en este trabajo practico?
B. menciona otros métodos separativos que conozcas.
miércoles, 18 de abril de 2012
2º AÑO DE IPEA 214
NORMAS DE SEGURIDAD EN EL LABORATORIO
Normas generales
· No fumes, comas o bebas en el laboratorio.
· Utiliza guardapolvo y tenlo siempre bien abrochado, así protegerás tu ropa.
· Guarda tus prendas de abrigo y los objetos personales en un armario o taquilla y no los dejes nunca sobre la mesa de trabajo.
· No lleves bufandas, pañuelos largos ni prendas u objetos que dificulten tu movilidad.
· Procura no andar de un lado para otro sin motivo y, sobre todo, no corras dentro del laboratorio.
· Si tienes el cabello largo, recógetelo.
· Dispón sobre la mesa sólo los libros y cuadernos que sean necesarios.
· Ten siempre tus manos limpias y secas. Si tienes alguna herida, tápala.
· No pruebes ni ingieras los productos.
· En caso de producirse un accidente, quemadura o lesión, comunícalo inmediatamente al profesor.
· Recuerda dónde está situado el botiquín.
· Mantén el área de trabajo limpia y ordenada.
Normas para manipular instrumentos y productos
· Antes de manipular un aparato o montaje eléctrico, desconéctalo de la red eléctrica.
· No pongas en funcionamiento un circuito eléctrico sin que el profesor haya revisado la instalación.
· No utilices ninguna herramienta o máquina sin conocer su uso, funcionamiento y normas de seguridad específicas.
· Maneja con especial cuidado el material frágil, por ejemplo, el vidrio.
· Informa al profesor del material roto o averiado.
· Fíjate en los signos de peligrosidad que aparecen en los frascos de los productos químicos.
· Lávate las manos con jabón después de tocar cualquier producto químico.
· Al acabar la práctica, limpia y ordena el material utilizado.
· Si te salpicas accidentalmente, lava la zona afectada con agua abundante. Si salpicas la mesa, límpiala con agua y sécala después con un paño.
· Evita el contacto con fuentes de calor. No manipules cerca de ellas sustancias inflamables. Para sujetar el instrumental de vidrio y retirarlo del fuego, utiliza pinzas de madera. Cuando calientes los tubos de ensayo con la ayuda de dichas pinzas, procura darles cierta inclinación. Nunca mires directamente al interior del tubo por su abertura ni dirijas esta hacia algún compañero.
· Todos los productos inflamables deben almacenarse en un lugar adecuado y separados de los ácidos, las bases y los reactivos oxidantes.
· Los ácidos y las bases fuertes han de manejarse con mucha precaución, ya que la mayoría son corrosivos y, si caen sobre la piel o la ropa, pueden producir heridas y quemaduras importantes.
· Si tienes que mezclar algún ácido (por ejemplo, ácido sulfúrico) con agua, añade el ácido sobre el agua, nunca al contrario, pues el ácido «saltaría» y podría provocarte quemaduras en la cara y los ojos.
· No dejes destapados los frascos ni aspires su contenido. Muchas sustancias líquidas (alcohol, éter, cloroformo, amoníaco...) emiten vapores tóxicos.
jueves, 5 de abril de 2012
PARA 6º quimica AÑO IPEA 214
VISITEN LA PAGINA DE INTERNET: www.100ciaquimica.net/forin/index.htm es para realizar el trabajo practico el dia miercoles....
lunes, 2 de abril de 2012
TEORIA ATOMICA PARA 4º AÑO DE IPEA 214
El Átomo
El estudio del átomo y su estructura ha pasado por varias etapas, pero hoy puede conceptualizarse de la siguiente manera...


El Atomismo Griego
Los filósofos griegos DEMÓCRITO de Abdera y su maestro Leucipo, en el siglo V a.C. alguna vez se preguntaron:
Más adelante te contaré como termina esta historia, pero ahora ayuda a estos filósofos a resolver su predicamento, realizando la siguiente actividad (dale un clik a la actividad 1):
Hace 2500 años los pensadores griegos Democríto y su maestro Leucipo recolectaron varios objetos, al igual que hoy un niño pequeño destruye un objeto para ver de qué está hecho o cómo funciona; los filósofos comenzaron a romper sus materiales para descubrir su composición. Después de múltiples divisiones y utilizando las más variadas herramientas de su época, llegó un momento en el que las fracciones eran tan pequeñas que ya no podían ser cortadas. Comparando la última fracción de cada objeto concluyeron:
A esta última fracción los griegos le dieron el nombre de ATOMNÉ (a que significa sin, y tomne que significa corte, atomne quiere decir: sin corte).
La aportación de Demócrito y Leucipo a la historia del átomo, fue una nueva palabra o concepto: ÁTOMO, que significa "Indivisible"

Primera Teoría Atómica
El concepto de átomo, que los griegos aportaron, prevaleció hasta finales del siglo XVIII. En 1809 el físico inglés JOHN DALTON meditó profundamente sobre la estructura de la materia y tras varios experimentos lo condujeron a postular la primer Teoría Atómica y con ella un primer modelo del átomo.
Teoría Atómica de Dalton
 Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2):
Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2):

Carácter Eléctrico de Átomo
Las ideas de Dalton perduraron sin cambio durante casi 100 años. Fue hasta 1897 cuando el físico inglés JOSEPH JOHN THOMSON se dedicó a investigar el comportamiento eléctrico de la materia.
Por medio de un disparador de partículas (como los antiguos televisores de cinescopio), Thomson proyectaba los rayos sobre una pantalla fluorescente y las colisiones iluminaban la pantalla, a estos rayos Thomson los denominó "Rayos Catódicos"

Thomsom estaba seguro que el choque o colisión de los átomos sobre la pantalla estumulaban la fluorescencia o la ilumancacion.
Posteriormente Thomson sometió los rayos catódicos a los efectos de campos magnéticos y observó que el rayo se bifurcaba, desviando su trayectoria en dos sentidos. (NO es aconcejable, pero si haz tenido la experiencia de acercar un imán a la pantalla de tu televisor, habrás observado que se deforman las imágenes y los colores; ésto mismo hizo Thomson de manera controlada).

Meditando los resultados de su experimento, Thomson concibió la idea de que el átomo propuesto por Dalton, efectivamente era una esfera pero que ésta tenía una carga positiva y que en ella se incurstaban pequeñas entidades desprendibles de carga negativa, a la que Thomson llamó: "ELECTRÓN".
Con todas sus demostraciones Thomson propuso un segundo modelo atómico conocido como "Gelatina con pasas" o "Panque con pasas", superando al modelo de Dalton y otorgándole propiedades eléctricas.

Una Mujer rompe el Átomo
Después de muchos años de estudio, tanto Demócrito, Dalton y Thomson coincidían en la idea de que el átomo era indivisible. Fue hasta 1895 cuando la polaca profesora en química MARIE CURIE demostró lo contrario: el átomo sí puede ser dividido.

¿Recuerdas las cámaras fotográficas que utilizan rollos de película? Entonces sabes que si expones el rollo a la luz, tus fotos se velarán; esto mismo le sucedía al físico francés HENRI BECQUEREL cuando sus rollos, aún cerrados, estaban cerca de un mineral llamado pechblenda. Bequerel sospechó que sus rollos se velaban a causa de algún elemento desconocido presente en el mineral y encargó a la profesora en química Marie Curie, que tratara de descubrir este elemento.
Fue así como Madame Curie y su esposo Pierre se dedicaron a estudiar el mineral. Lograron identificar nuevos materiales que tenían la propiedad de radiar energía de manera espontanea, a esta propiedad los esposos Curie la lamaron Radiactividad. Tiempo después revelaron el descubrimiento de tres nuevos elementos, todos radiactivos: Radio (Ra), el más radiactivo de todos, el Uranio (U) y el Polonio (Po).

Radiactividad: fenómeno natural que presentan algunos materiales y que consiste en la emisión espontanea de alta energía. Hoy sabemos que los elementos que tienen un número atómico mayor que 82 (es decir más de 82 protones en su núcleo), son radiactivos.
El Uranio (U) tiene un número atómico de 92 (recuerda que si el Número Atómico es mayor que 82, es un elemento radiactivo), cuando emite radiación, perderá dos protones y su número atómico cambia a 90, el elemento con número atómico 90 es el Torio (Th), a este fenómeno se le conoce como TRANSMUTACIÓN
Hoy en día se aprovecha la energía de los elementos radiactivos en plantas nucleoeléctricas controlando la radiactividad por medio de la Fisión y la Fusión Nuclear:

Más Partículas en el Átomo
Para 1909 el físico neozelandés ERNEST RUTHERFORD, encerró pechblenda en una caja de Plomo (Pb) para impedir la salida de radiación, perforó una pared de la caja, por donde escapaba la radiactividad y la observada sobre una pantalla fluorescente, sometió esa radiación a campos electromagnéticos y observó lo siguiente:

Efectivamente, con este experimento Rutherford demostró que el átomo al desintegrarse emite tres diferentes clases de partículas o rayos: Uno se desviaba al campo electropositivo (los electrones) a los que Rutherford denominó: "Rayos Beta". Otro rayo se dirigía al campo electronegativo, al cual lo llamó: "Rayos Alfa", que posteriormente los llamaría: "PROTONES". Y un tercer rayo que era indiferente a los campos electromagnéticos, a esos Rutherford los llamó: "Rayos Gama", tiempo despues junto con el físico inglés James Chadwick los denominarón: NEUTRONES
Con otro experimento Rutherford bombardeó una delgada lámina de oro con rayos alfa (protones o partículas de carga positiva):
Observando ésto, Rutherfor se pregunto: ¿por qué algunos protones atraviesan libremente la lámina de oro?, ¿por qué otros atraviesan la lámina pero desvían su trayectoria? y ¿por qué otros protones rebotaban en la lámina? ¿Tú qué te imaginas?
Al igual que tú, Rutherford concluyó:
Todos estos análisis condujeron a Rutherford a proponer un nuevo modelo atómico conocido como "Nube de Electrones":
El modelo de Rutherford explica que el átomo está constituido por dos regiones: la central y que contiene el 99% de la masa del atómo la llamó: NÚCLEO. En esta zona están contenidos los protones y los neutrones. Por último Rutherford colocó muy lejos del núcleo los electrones, el 1% restante de la masa del átomo, diciendo que como una nube, los electrones envuelven caóticamente al núcleo.


Un Sistema Solar en el Átomo
El físico danés NIELS BÖHR en 1913 sugirió un nuevo modelo atómico basado en el modelo de Rutherford. Aplicando la recién Teoría Cuántica propuso que los electrones se encontraban girando al rededor del núcleo en determinadas y bien definidas regiones a las que Böhr llamó NIVELES DE ENERGÍA, contrario a la distribución caótica del modelo anterior. Böhr.

El Modelo Atómico de Böhr respetó la constitución del núcleo, pero acomodó los electrones en siete niveles de energía, a los cuales Böhr señaló con las letras mayúsculas:
Böhr aseguraba que estos niveles son como las órbitas descritas por los planetas al girar al rededor del Sol, sin embargo, a diferencia de éste, en cada órbita puede haber más de un electrón, y que cada nivel energético sólo se puede mantener una cantidad máxima de electrones, de la siguiente manera:
Vamos a elaborar algunos modelo atómico según Böhr,
con la siguiente actividad. (dale un clik a la actividad 4)

Discretos Niveles de Energía
Para 1926 el austriaco ERWIN SCHRÖDINGER echó abajo los trabajos de Böhr al postular el Principio de Incertidumbre:
Partiendo de la teoría de onda - partícula, Schrödinger ideó un Modelo Atómico usando la Mecánica Cuantica Ondulatorio y conceptos matemáticos de probabilidad. Este modelo continua siendo la base de los conceptos modenos acerca de la estructura atómica y explica que los niveles de energía, propuestos por Böhr, están constituidos por subniveles de energía u orbitales, regiones aún más discretas que forman a las capas electrónicas o niveles energéticos.
Así como los niveles de Böhr, los subniveles de Schrödinger fueron denominados por letras, pero para diferenciarlos éstas fueron minúsculas:
Los subniveles u orbitales son espacios probables donde quizá se localice un electrón. Dependiendo del subnivel, se configuran las siguientes zonas o espacios de probabilidad:

Y al igual que las orbitas, los orbitales tienen una capacidad máxima de electrones:
La siguiente imagen muestra el último Modelo Atómico:

En este último modelo del átomo, el principal interés es determinar dónde es posible encontrar un electrón.
EL ÁTOMO ES EL COMPONENTE BÁSICO DE TODO EL UNIVERSO

ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA LAS PROPIEDADES DE UN ELEMENTO

EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA

ES LA PARTÍCULA MÁS PEQUEÑA QUE CONSERVA LAS PROPIEDADES DE UN ELEMENTO

EXISTEN 118 ÁTOMOS DISTINTOS, SU NOMBRE, COMPOSICIÓN Y ESTRUCTURA ESTÁN REGISTRADOS EN LA TABLA PERIÓDICA

Historia del Átomo

El Atomismo Griego
Los filósofos griegos DEMÓCRITO de Abdera y su maestro Leucipo, en el siglo V a.C. alguna vez se preguntaron:
¿De qué están hechas las cosas?
Más adelante te contaré como termina esta historia, pero ahora ayuda a estos filósofos a resolver su predicamento, realizando la siguiente actividad (dale un clik a la actividad 1):
Hace 2500 años los pensadores griegos Democríto y su maestro Leucipo recolectaron varios objetos, al igual que hoy un niño pequeño destruye un objeto para ver de qué está hecho o cómo funciona; los filósofos comenzaron a romper sus materiales para descubrir su composición. Después de múltiples divisiones y utilizando las más variadas herramientas de su época, llegó un momento en el que las fracciones eran tan pequeñas que ya no podían ser cortadas. Comparando la última fracción de cada objeto concluyeron:
"Todos los objetos existentes están conformados
por pequeñísimas partículas indivisibles"
por pequeñísimas partículas indivisibles"
A esta última fracción los griegos le dieron el nombre de ATOMNÉ (a que significa sin, y tomne que significa corte, atomne quiere decir: sin corte).
La aportación de Demócrito y Leucipo a la historia del átomo, fue una nueva palabra o concepto: ÁTOMO, que significa "Indivisible"

Primera Teoría Atómica
El concepto de átomo, que los griegos aportaron, prevaleció hasta finales del siglo XVIII. En 1809 el físico inglés JOHN DALTON meditó profundamente sobre la estructura de la materia y tras varios experimentos lo condujeron a postular la primer Teoría Atómica y con ella un primer modelo del átomo.
Teoría Atómica de Dalton
- Toda la meteria está formada por partículas extraordinariamente pequeñas, sólidas y esféricas llamadas átomos.
- Todos los átomos de un mismo elemento son iguales entre sí, particularmente en peso y volumen, pero diferentes a los átomos de otro elemento.
- La combinación de átomos da lugar a nuevas sustancias a las que llamamos compuestos.
- Los átomos permanecen indivisibles, incluso en las reacciones más violentas.
 Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2):
Para evaluar qué tanto comprendiste la Teoría Atómica de Dalton te propongo que realices la siguiente actividad (dale un clik a la actividad 2): 
Carácter Eléctrico de Átomo
Las ideas de Dalton perduraron sin cambio durante casi 100 años. Fue hasta 1897 cuando el físico inglés JOSEPH JOHN THOMSON se dedicó a investigar el comportamiento eléctrico de la materia.
Pero mejor dejemos al propio J. J. Thomson contarte qué fue lo que hizo:
(El siguiente video está en portugués pero si pones suficiente atención a los subtítulos podrán entenderlo)
(El siguiente video está en portugués pero si pones suficiente atención a los subtítulos podrán entenderlo)
Por medio de un disparador de partículas (como los antiguos televisores de cinescopio), Thomson proyectaba los rayos sobre una pantalla fluorescente y las colisiones iluminaban la pantalla, a estos rayos Thomson los denominó "Rayos Catódicos"
Observa la imágen, medita y explica el experimento de Thomson

Thomsom estaba seguro que el choque o colisión de los átomos sobre la pantalla estumulaban la fluorescencia o la ilumancacion.
Posteriormente Thomson sometió los rayos catódicos a los efectos de campos magnéticos y observó que el rayo se bifurcaba, desviando su trayectoria en dos sentidos. (NO es aconcejable, pero si haz tenido la experiencia de acercar un imán a la pantalla de tu televisor, habrás observado que se deforman las imágenes y los colores; ésto mismo hizo Thomson de manera controlada).
Observa la imágen, medita y explica el experimento de Thomson

Meditando los resultados de su experimento, Thomson concibió la idea de que el átomo propuesto por Dalton, efectivamente era una esfera pero que ésta tenía una carga positiva y que en ella se incurstaban pequeñas entidades desprendibles de carga negativa, a la que Thomson llamó: "ELECTRÓN".
Con todas sus demostraciones Thomson propuso un segundo modelo atómico conocido como "Gelatina con pasas" o "Panque con pasas", superando al modelo de Dalton y otorgándole propiedades eléctricas.

Una Mujer rompe el Átomo
Después de muchos años de estudio, tanto Demócrito, Dalton y Thomson coincidían en la idea de que el átomo era indivisible. Fue hasta 1895 cuando la polaca profesora en química MARIE CURIE demostró lo contrario: el átomo sí puede ser dividido.

¿Recuerdas las cámaras fotográficas que utilizan rollos de película? Entonces sabes que si expones el rollo a la luz, tus fotos se velarán; esto mismo le sucedía al físico francés HENRI BECQUEREL cuando sus rollos, aún cerrados, estaban cerca de un mineral llamado pechblenda. Bequerel sospechó que sus rollos se velaban a causa de algún elemento desconocido presente en el mineral y encargó a la profesora en química Marie Curie, que tratara de descubrir este elemento.
Fue así como Madame Curie y su esposo Pierre se dedicaron a estudiar el mineral. Lograron identificar nuevos materiales que tenían la propiedad de radiar energía de manera espontanea, a esta propiedad los esposos Curie la lamaron Radiactividad. Tiempo después revelaron el descubrimiento de tres nuevos elementos, todos radiactivos: Radio (Ra), el más radiactivo de todos, el Uranio (U) y el Polonio (Po).

Radiactividad: fenómeno natural que presentan algunos materiales y que consiste en la emisión espontanea de alta energía. Hoy sabemos que los elementos que tienen un número atómico mayor que 82 (es decir más de 82 protones en su núcleo), son radiactivos.
Los elementos radiactivos desprende partículas Alfa (dos protones, dos neutrones y gran cantidad de energía), de modo que cuando un átomo irradia energía también se desintegra pierdiendo protones y con ello su personalidad, analicemos un ejemplo:
El Uranio (U) tiene un número atómico de 92 (recuerda que si el Número Atómico es mayor que 82, es un elemento radiactivo), cuando emite radiación, perderá dos protones y su número atómico cambia a 90, el elemento con número atómico 90 es el Torio (Th), a este fenómeno se le conoce como TRANSMUTACIÓN
Hoy en día se aprovecha la energía de los elementos radiactivos en plantas nucleoeléctricas controlando la radiactividad por medio de la Fisión y la Fusión Nuclear:
Veamos entonces qué tanto comprendiste de la radiactividad, realizando la siguiente actividad (dale un clik a la actividad 3):

Más Partículas en el Átomo
Para 1909 el físico neozelandés ERNEST RUTHERFORD, encerró pechblenda en una caja de Plomo (Pb) para impedir la salida de radiación, perforó una pared de la caja, por donde escapaba la radiactividad y la observada sobre una pantalla fluorescente, sometió esa radiación a campos electromagnéticos y observó lo siguiente:
Observa la imágen, medita y explica el experimento de Rutherford

Efectivamente, con este experimento Rutherford demostró que el átomo al desintegrarse emite tres diferentes clases de partículas o rayos: Uno se desviaba al campo electropositivo (los electrones) a los que Rutherford denominó: "Rayos Beta". Otro rayo se dirigía al campo electronegativo, al cual lo llamó: "Rayos Alfa", que posteriormente los llamaría: "PROTONES". Y un tercer rayo que era indiferente a los campos electromagnéticos, a esos Rutherford los llamó: "Rayos Gama", tiempo despues junto con el físico inglés James Chadwick los denominarón: NEUTRONES
Con otro experimento Rutherford bombardeó una delgada lámina de oro con rayos alfa (protones o partículas de carga positiva):
Observa el video, medita y explica el experimento de Rutherford
Observando ésto, Rutherfor se pregunto: ¿por qué algunos protones atraviesan libremente la lámina de oro?, ¿por qué otros atraviesan la lámina pero desvían su trayectoria? y ¿por qué otros protones rebotaban en la lámina? ¿Tú qué te imaginas?
Al igual que tú, Rutherford concluyó:
- PRIMERO: Sí la lámina contiene átomos y los protones bombardeados no chocan con nada, puesto que pasan libremente, significa que hay espacio vacío entre un átomo y otro;
- SEGUNDO: Sí se está bombardeando con cargas positivas y al atravezar la lámina solo desvían su trayectoría, significa que el protón pasa rozando al átomo de oro al tiempo que es repelido. Se entiende entonces que los átomos en su parte central poseen cargas positivas (recuerda que en magnetismo y electricidad: signos o cargas iguales: se repelen; signos o cargas diferentes: se atraén);
- TERCERO: Los protones bombardeados que no logran atravezar la lámina y son rebotados, están chocando directamente con una región del átomo de gran tamaño o con gran cantidad de masa.
Todos estos análisis condujeron a Rutherford a proponer un nuevo modelo atómico conocido como "Nube de Electrones":
El modelo de Rutherford explica que el átomo está constituido por dos regiones: la central y que contiene el 99% de la masa del atómo la llamó: NÚCLEO. En esta zona están contenidos los protones y los neutrones. Por último Rutherford colocó muy lejos del núcleo los electrones, el 1% restante de la masa del átomo, diciendo que como una nube, los electrones envuelven caóticamente al núcleo.


Un Sistema Solar en el Átomo
El físico danés NIELS BÖHR en 1913 sugirió un nuevo modelo atómico basado en el modelo de Rutherford. Aplicando la recién Teoría Cuántica propuso que los electrones se encontraban girando al rededor del núcleo en determinadas y bien definidas regiones a las que Böhr llamó NIVELES DE ENERGÍA, contrario a la distribución caótica del modelo anterior. Böhr.

El Modelo Atómico de Böhr respetó la constitución del núcleo, pero acomodó los electrones en siete niveles de energía, a los cuales Böhr señaló con las letras mayúsculas:
- K: al nivel más cercano al núcleo y que se vincula directamente con el primer periodo de la tabla periódica;
- L: al segundo nivel o capa de electrones, relacionado con periodo dos de la tabla;
- M: al tercer nivel energético del átomo o 3er periodo de la tabla ;
- N: a la cuarta capa de electrones o 4o periodo;
- O: la quinto nivel o 5o periodo;
- P: al sexto nivel o 6o periodo, y;
- Q: al último nivel energétido, el más alejado del núcleo y que se relaciona con el séptimo periodo de la tabla periódica.
Böhr aseguraba que estos niveles son como las órbitas descritas por los planetas al girar al rededor del Sol, sin embargo, a diferencia de éste, en cada órbita puede haber más de un electrón, y que cada nivel energético sólo se puede mantener una cantidad máxima de electrones, de la siguiente manera:
- En K, de un electrón y hasta dos electrones ( e- );
- En L, de uno y hasta 8 electrones;
- En M, de 1 e- y hasta 18 e- ;
- En N, de 1 e- y hasta 32 e- ;
- En O, 1 e- y hasta 32 e- ;
- En P, 1 e- y hasta 18 e- , y;
- En Q, 1 e- y hasta 8 e-
Vamos a elaborar algunos modelo atómico según Böhr,
con la siguiente actividad. (dale un clik a la actividad 4)

Discretos Niveles de Energía
Para 1926 el austriaco ERWIN SCHRÖDINGER echó abajo los trabajos de Böhr al postular el Principio de Incertidumbre:
"Es imposible conocer con exactitud la posición y velocidad de un electrón"
Partiendo de la teoría de onda - partícula, Schrödinger ideó un Modelo Atómico usando la Mecánica Cuantica Ondulatorio y conceptos matemáticos de probabilidad. Este modelo continua siendo la base de los conceptos modenos acerca de la estructura atómica y explica que los niveles de energía, propuestos por Böhr, están constituidos por subniveles de energía u orbitales, regiones aún más discretas que forman a las capas electrónicas o niveles energéticos.
Así como los niveles de Böhr, los subniveles de Schrödinger fueron denominados por letras, pero para diferenciarlos éstas fueron minúsculas:
- s: del inglés "sharp", que significa agudo o cerrado;
- p: significa principal;
- d: del ingles "diffuse" que significa difuso;
- f: significa fundamental.
Los subniveles u orbitales son espacios probables donde quizá se localice un electrón. Dependiendo del subnivel, se configuran las siguientes zonas o espacios de probabilidad:

Y al igual que las orbitas, los orbitales tienen una capacidad máxima de electrones:
- s: de un electrón y hasta 2 electrónes ( e- );
- p: de 1 e- y hasta 6 e- ;
- d: de 1 e- y hasta 10 e- , y;
- f: de 1 e- y hasta 14 e-
La siguiente imagen muestra el último Modelo Atómico:

En este último modelo del átomo, el principal interés es determinar dónde es posible encontrar un electrón.
Suscribirse a:
Entradas (Atom)
