Sistema
Se puede definir un sistema comoun conjunto de materia que está limitado por una superficie real o imaginaria.
Si en el sistema no entra ni sale materia se dice que se trata de un sistema cerrado o sistema aislado, dependiendo del caso. Los tipos de sistemas cerrados que son necesarios para el estudio de la termodinámica son:
- Sistema aislado térmicamente: es un sistema cerrado en el que no entra ni sale calor.
- Sistema aislado mecánicamente: es un sistema cerrado sobre el cual no se realiza trabajo.


http://www.100ciaquimica.net/temas/tema5/index.htm
Una imagen nos aclara los tipos de sistemas:
- Tarea 1. Busca ejemplos de sistemas termodinámicos abiertos, cerrados y aislados (al menos dos de cada tipo).
- Hay un principio cero en termodinámica, y es el que establece que dos cuerpos a distinta temperatura llegan al equilibrio térmico cuando se ponen en contacto. La energía se transfiere de uno a otro en forma de calor (¿recuerdas la diferencia entre calor y temperatura?) Puedes desempolvar conocimientos con el tema completo de la editorial SM:
- El sistema, la parte del universo que es objeto de nuestro estudio, puede ser observado y descrito en función de unas magnitudes macroscópicas conocidas como variables termodinámicas (temperatura, volumen, presión, densidad etc.) Estas variables se clasifican en intensivas o extensivas, según dependan o no de la cantidad de materia, pero nos interesa más el concepto de variables o funciones de estado (las que dependen sólo del estado final e inicial del sistema, pero no del proceso de cambio). Al contrario que en el poema, lo importante es la meta, no el camino.

- Tarea 2. a) Clasifica las siguientes variables en intensivas o extensivas: temperatura, masa, densidad, intensidad de campo eléctrico, índice de refracción, volumen, presión, coeficiente de dilatación térmica; b) Explica qué es una función de estado tomando como símil la altura de una montaña y el desplazamiento realizado para subirla.
- Lo que nos interesa en termoquímica es calcular el calor y el trabajo intercambiados en los procesos químicos. Hay que prestar atención a las condiciones en que se dan esos procesos (con cambio (1) o no (2) de estado, para el calor; cómo son P, T, V, Q… para el trabajo), y a las unidades en que nos dan los datos:
- Tarea 3. a) Dibuja la curva de calentamiento correspondiente al proceso por el cual 200 g de hielo a -20º C se transforman en vapor de agua a 150º C; b) calcula la cantidad de calor implicada en dicho calentamiento (localiza los datos necesarios de calores latentes y específicos en Internet); c) deduce las expresiones que corresponden al trabajo de expansión de un gas en condiciones isotérmicas, adiabáticas, isobáricas e isocóricas.
- Tarea 4. Aplica las expresiones encontradas para la tarea 3-c a los casos de las animaciones siguientes (o en esta), comprobando el resultado:
- ¡Cuántas veces nos sentimos sin energía! Pero esa es una sensación que no se corresponde a la verdad termodinámica. Cada una de las partículas que tenemos se mueve, rota, vibra (tiene energía cinética), experimenta fuerzas de atracción inter e intramoleculares (posee energía potencial), y la suma de todas esas energías es lo que llamamos U, energía interna. Nos damos cuenta de subidas o bajones en nuestra energía, pero no sabemos cuánta tenemos. Lo mismo sucede con U, que es una función de estado: podemos conocer cuánto varía, no su valor absoluto. De ahí al primer principio de la termodinámica sólo va una ecuación:
- Tarea 4. Encuentra las expresiones correspondientes a la variación de energía interna de un gas que se expande: a) a presión constante; b) a volumen constante; c) a temperatura constante; d) en condiciones adiabáticas.
- Como la mayor parte de los procesos trancurren a presión constante (la atmosférica), es útil definir una nueva función de estado, que represente el calor intercambiado en esas circunstancias (Qp). Esta función se llama entalpía (H). La relación entre su variación y la variación de energía interna ofrece expresiones muy interesantes, que siempre tienen presente el primer principio de la termodinámica:
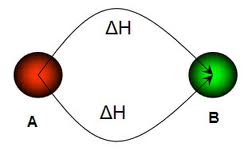
- En las ecuaciones termoquímicas se representan reacciones químicas indicando no sólo las sustancias y coeficientes estequiométricos que intervienen, sino también el estado físico en que se encuentran y la cantidad de calor puesto en juego en el proceso. Si el sistema absorbe calor, la reacción se llama endotérmica (diagrama entálpico de la izquierda); si lo desprende, se dice que la reacción es exotérmica (diagrama entálpico de la derecha). Con un mínimo nivel de inglés puedes entender esta animación flash sobre reacciones exotérmicas y endotérmicas. También puedes hacer observaciones cualitativas del signo de la variación de entalpía en el laboratorio.
- Tarea 5. Utilizando los valores de entalpías de esta tabla u otras disponibles en Internet, predice el carácter exotérmico o endotérmico de las reacciones: a) monóxido de carbono (g) + oxígeno (g) —> dióxido de carbono (g); b) óxido férrico (s) + carbono (s) —> hierro (s) + dióxido de carbono (g); c) etino (g) + hidrógeno (g) —-> etano (g); b) dibuja el diagrama entálpico de cada una de ellas.
- En ocasiones, no es posible llegar a la meta por el camino más rápido, y es mejor dar algún que otro rodeo. Como la entalpía es función de estado, la ley de Hess nos indica que la variación de entalpía de un proceso directo es igual a la suma de las variaciones de entalpía de cada uno de los etapas que dan lugar al mismo. Vamos, que todos los caminos llevan a Roma:
- Tarea 6. a) Resuelve el ejercicio propuesto en la primera pantalla del enlace indicado, y comprueba después la solución; b) aplica de nuevo la ley de Hess en los problemas B, C y D que se enlazan (incluyen la respuesta).
- Para entender cómo se aplica la ley de Hess en un ejercicio típico, aquí tienes la explicación del número 20 de la página 170 del libro de la editorial Oxford, tal y como se cuenta en clase con la pizarra Promethean (sólo hay una para todo el insti… ¡Y en otros sitios están infrautilizadas!)
- En plan “cutrearchivo de urgencia”, enlazo la correción de otros ejercicios del tema de termoquímica (todo sea por evitar fotocopias, y por ganar el tiempo del que no disponemos en clase): Resolución de ejercicios sobre la ley de Hess (libro Oxford). Para seguir ampliando, una animación de la ley de Hess.
- En una reacción química cualquiera, ocurre que podemos calcular la entalpía de esa reacción con una fórmula, donde figuran las entalpías de formación de productos y reactivos (cuyos datos se recogen en tablas). Hay que tener en cuenta que la entalpía es una magnitud extensiva, así que habrá que multiplicar cada entalpía por el correspondiente número de moles:

- Si lo que estudiamos es la entalpía estándar de reacción, estaremos trabajando a 1 atm de presión , 25º C y disoluciones 1 M. Debemos ajustar la ecuación termoquímica convenientemente (por ejemplo, si es de formación, para obtener 1 mol del compuesto, como en la reacción de formación del agua, H2(g) + ½ O2(g) —> H2O(l) ). La fórmula anterior se mantiene, indicando el estado estándar con un º de superíndice. Comprueba que se cumple con el siguiente ejercicio ”on line”.
ΔH0 = ΔH0productos - ΔH0reactivos
- Hay procesos que implican un nombre específico para las entalpías implicadas: por ejemplo, los de combustión (que tiene como productos dióxido de carbono y agua) y los de hidrogenación (la adición de hidrógeno a 1 mol de una sustancia insaturada). Otro caso es el de las entalpías de enlace, definida como la energía necesaria para romper un mol de enlaces entre átomos en estado gaseoso:
- Tarea 7. Aplica lo aprendido sobre entalpías de enlace haciendo el ejercicio E, cuya solución se indica en la misma página.
- Los datos de varición de entalpía que encontramos en las tablas, ¿de dónde salen? El laboratorio está para experimentar (te tocará hacerlo con hidróxido de sodio y ácido clorhídrico, como se pide para la PAU). Con calorímetros (para datos de Qp, imagen superior), con bombas de calor (para datos de Qv, imagen inferior, y también en applet)…
- Tarea 8. Describe el procedimiento experimental necesario para comprobar el calor desprendido en la reacción correspondiente a la neutralización de hidróxido sódico con ácido nítrico, para dar nitrato de sodio y agua. (Aquí tienes un laboratorio virtual y un vídeo).
- Saber qué pasa con la energía de un proceso no nos ayuda a determinar si sucede o no espontámente. Podemos intuir (por repetida experiencia) que la naturaleza tiende al desorden (¿o cómo están vuestras habitaciones?). Una copa se rompe en mil pedazos, pero los mil pedazos nunca hacen una copa; nos tiramos a la piscina, pero no salimos volando hacia arriba. Las cosas suceden espontáneamente en un sentido, pero no en otro. El concepto asociado a esta idea es el de entropía, que mide el grado de desorden de un sistema. Se designa con la letra S, y se mide en J/K. La entropía aumenta con la temperatura, y es mayor en gases, que en líquidos, que en sólidos (¿por qué?):

- La variación de entropía del universo ha de tener en cuenta la del sistema y la del ambiente o entorno. El segundo principio de la termodinámica establece que esa variación es positiva en los procesos espontáneos:
- Todos los casos posibles para la evolución de un proceso son:

- No hay dos sin tres, según el refranero. El tercer principio de la termodinámica asigna el valor cero de entropía al de las sustancias que se encuentren como cristales perfectos en el cero absoluto de temperaturas (0 K), así que la Sº (entropía estándar), a 2º C, será un valor distinto, y positivo. Para un proceso cualquiera, el cálculo de la variación de entropía no podía ser otro que:
ΔSreac = ∑ΔSproductos - ∑ΔSreactivos
(con los datos en entropías en las correspondientes tablas).
- Tarea 9. Valora, cualitativamente, el signo de la variación de entropía de las reacciones de las tareas 5, 6, 7 y 8 (recuerda prestar atención al número de moles gaseosos en el primer y segundo miembros de la ecuación termoquímica, y al grado de compeljidad de las sustancias).
- ¿Cómo sabemos si la entropía del universo ha aumentado o disminuido? Sería bastante más sencillo comprobar cómo ha sido la variación de entropía de nuestro sistema (esa pequeña parte que estudiamos). Considerando que la temperatura del entorno no se ve afectada por la absorción o cesión de calor por parte del sistema, y que la mayor parte de los procesos tienen lugar a presión constante, sucederá que:
- Semejante conclusión nos llevará a definir una nueva (¡y última!) función termodinámica, la energía libre de Gibbs (G):
G = H - T S
cuya variación (¡oh, sorpresa!), es, justamente:
ΔG = - T Δ Suniverso
lo que queríamos, ni más ni menos, una forma de relacionar la variación de entropía del universo con datos de nuestro sistema. La variación de la energía libre de Gibbs en un proceso se calculará como:
ΔGreac = ∑ΔGproductos - ∑ΔGreactivos
- Tarea 10. Comprueba, con la siguiente interactividad, cómo varía la energía libre de Gibbs:
- No nos sorprenderá ya, a estas alturas, que la energía libre de formación estándar (Gºf) se defina como ΔG para un proceso en el que se forma 1 mol de un compuesto a partir de sus elementos, en condiciones estándar y en su estado termodinámico más estable. Para los elementos, ΔGºf = 0.
- Tarea 11. Observa los ejemplos de problemas sobre la energía de Gibbs expuestos en este enlace, y realiza el ejercicio F.
- ¿Y para qué queríamos G? Para poder predecir la espontaneidad de las reacciones en función de variables de nuestro sistema, en lugar de fijándonos en la variación de entropía del universo (aunque es lo que en el fondo decide). El criterio de espontaneidad de una reacción es:
- Para predecir cualitativamente la espontaneidad o no de una reacción, hay que tener en cuenta los valores de entalpía, temperatura y entropía. Una imagen, mejor que mucho rollo:

- La última ecuación del tema será la que nos ayude a calcular ΔG cuando el proceso se desarrolla en condiciones no estándar, o en el caso de que el sistema esté en equilibrio:
- Tarea 13. Visita el capítulo del Proyecto Ulloa dedicado a la termoquímica, y resuelve las actividades propuestas:
- Aunque está en portugués (¿qué problema es ese para los alumnos de A Veiga o Navia?), un buen vídeo de aproximación a los conceptos de calor y temperatura:
- Encontrarás animaciones de termodinámica y cinética química en:
- Puedes repasar el tema y ampliar conocimientos con una presentación de diapositivas, ejercicios resueltos, ejercicios propuestos etc. (ingente trabajo de Carmen Peña en moodle).
- Y unos curiosos e interesantes vídeos para aclararse con los conceptos de termoquímica (de la mítica serie “Universo mecánico”), de copas en un bar, o de paseo por el Ártico:
(be patient!)
(éste aclara el concepto de entropía)
- Si has llegado al final de este vídeo, te interesará ver el siguiente (el número 4 de los relacionados). Ahí te enterarás del sentido de la flecha termodinámica del tiempo. ¿Por qué no recordamos el futuro, en lugar del pasado?
- Un poco más de termodinámica interactiva, para mentes inquietas y alumnos trabajadores… ¡Que no se diga!
- Haciendo un favor al planeta y un ahorro al estado, prescindimos de las engorrosas fotocopias, pero no te dejamos sin tarea: ejercicios de termoquímica, con la solución, y otras cuestiones y problemas para hacer usando el ratón. Tienes un buen repaso de la teoría en esta web, recursos multimedia en la ahí enlazada, un buen resumen “chuleta” y el imprescindible esquema:
- Ya sabes que dispones de los exámenes de PAU de 2000 á 2008, de Asturias, con soluciones ( cortesía del IES de Luarca), el problema de 2009 y todos los del año 2010.
- Recuerda que en el tema de termoquímica hay un apartado dedicado a las aplicaciones energéticas de las reacciones químicas (combustibles, alimentos, dispositivos autoenfriables y autocalentables), y que se mencionan dos problemas medioambientales muy relevantes en nuestros días: la subida de temperaturas y su relación con el efecto invernadero, y la lluvia ácida.



















No hay comentarios:
Publicar un comentario